糖鎖合成酵素FUT8の分泌の仕組みを解明
2026年2月2日
岐阜大学
炎症やCOPDなどに関わる糖鎖の新たな制御機構 〜糖鎖合成酵素FUT8の分泌の仕組みを解明〜
本研究のポイント
・FUT8は、タンパク質に付いた糖鎖の根元にコアフコースと呼ばれる構造を作る酵素で、炎症、COPD、がんなどに関わっています。
・FUT8の一部は、SPPおよびSPPL3という二つのプロテアーゼにより切断されることで、細胞外へ分泌されることがわかりました。
・FUT8がSPPやSPPL3により切断されると、FUT8がコアフコースを付けるタンパク質の種類が変化することがわかりました。
研究概要
岐阜大学糖鎖生命コア研究所の木塚 康彦教授、連合農学研究科博士課程修了生の富田 晟太さん(現:名古屋市立大学薬学研究科特任助教)らの研究グループは、名古屋大学のRebeca Kawahara特任准教授らとの共同研究で、炎症や慢性閉塞性肺疾患(COPD)に関わる糖鎖を作る酵素FUT8の新たな制御の仕組みを解明しました。
タンパク質に付く糖鎖には膨大な種類が存在し、これら糖鎖は様々な生命現象や疾患において重要な役割を担っています。これら糖鎖は、細胞の中で様々な糖転移酵素(糖鎖合成酵素)の働きによって作られます。これまで、約180種類のヒトの糖転移酵素はほとんど全てが同定されましたが、これら酵素の働きが細胞内で調節される仕組みや、個々のタンパク質に付く糖鎖の形がどのように決まるのかは、まだあまりわかっていません。
本研究では、炎症、COPD、がんなどに関わる糖鎖(コアフコース)を作る酵素、FUT8に着目し、その活性が細胞内で調節される仕組みを調べました。その結果、本来細胞内に存在するFUT8の一部は、SPP、SPPL3という2つのプロテアーゼにより切断されて細胞外へ分泌されることがわかりました。またこの切断によって、FUT8がコアフコースを付けるタンパク質の種類が変化することも明らかになりました。これらの成果は、体内で複雑な糖鎖が作られる仕組みの解明と、FUT8が関わる様々な疾患の病態解明へつながることが期待されます。
本研究成果は、現地時間2026年1月28日にThe Journal of Biological Chemistry誌のオンライン版で発表されました。
研究背景
糖鎖1)とは、グルコースなどの糖(動物では約10種類の糖が存在)が枝分かれしながら鎖状につながったもので、多くはタンパク質や脂質などに結合した状態で存在しています。動物では、体内の半数程度のタンパク質に糖鎖が付いていると考えられており、糖鎖を持つタンパク質は糖タンパク質と呼ばれています。タンパク質に付いている糖鎖には様々な形のものがあり、タンパク質ごとに糖鎖の形が異なること、また同じタンパク質でも、健康なときと病気のときとで糖鎖の形が変化することなどが知られています。特に、疾患特異的な糖鎖の変化は、実際に医療の現場でがんの診断などに使われており、糖鎖の変化をもたらす仕組みの解明は、医療応用を考える上でも重要です。
タンパク質に付く糖鎖は、細胞の中で糖転移酵素2)(糖鎖合成酵素)と呼ばれる酵素の働きによって作られます。ヒトの体内には、約180種類の糖転移酵素が存在し、それらの働きが厳密に制御されることで、膨大な種類の糖鎖が作られます。
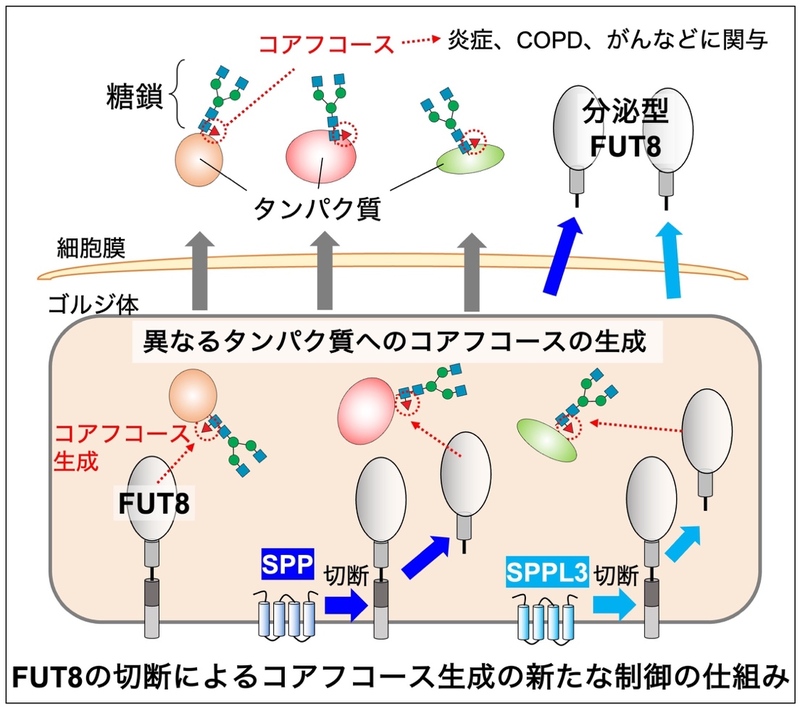
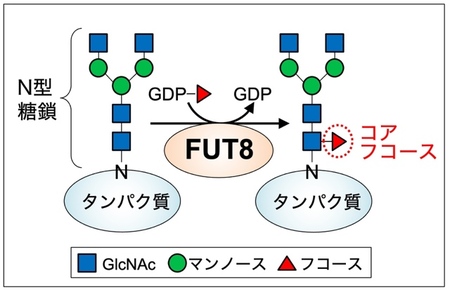
糖転移酵素のうち、FUT8 3)は、タンパク質に付いたN型糖鎖4)と呼ばれる糖鎖の根元に作用して、コアフコースと呼ばれる構造を作る酵素です(図1)。これまでの研究で、FUT8が作るコアフコースの減少は、慢性閉塞性肺疾患(COPD)5)、COVID19 6)の重症化、免疫機能低下、などを引き起こすこと、またFUT8の過剰な働きは皮膚がんや肺がんなどの悪性化に関わるとの報告があることから、FUT8が作る糖鎖は適切な量で存在することが重要だと考えられます。このように、FUT8の作るコアフコースの機能や疾患との関係性が明らかにされてきた一方で、FUT8の細胞内での活性が制御される仕組みはよくわかっていませんでした。そこで本研究では、FUT8の細胞外への分泌に着目し、それによりFUT8の働きが制御される仕組みを調べました。
研究成果
多くの糖転移酵素は、細胞内のゴルジ体7)と呼ばれる小器官において、膜を貫通した状態で存在しています。一方、一部の糖転移酵素は、プロテアーゼ8)と呼ばれる酵素群により切断され、活性を保ったまま細胞外へ分泌されることが以前から知られていました(図2)。そして近年、この糖転移酵素の細胞外への分泌は、細胞内における糖転移酵素の活性の調節に重要な働きがあることがわかってきました(https://www.gifu-u.ac.jp/about/publication/press/20220801.pdf)。FUT8の分泌については、細胞外に存在すること自体はわかっていましたが、どのような仕組みで分泌されるのか、また分泌されることの意義については全くわかっていませんでした。
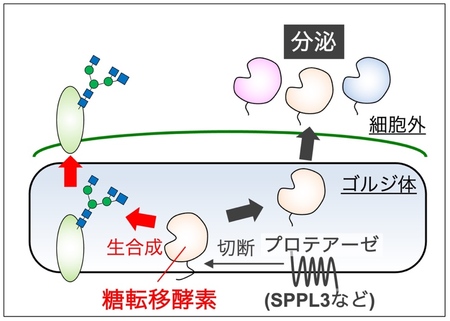 図2 糖転移酵素の分泌。多くの糖転移酵素は通常、細胞内のゴルジ体と呼ばれる小器官の膜に突き刺さって存在し、糖鎖を生合成する。一部の糖転移酵素は、プロテアーゼによって切断され、活性を保ったまま細胞外へ分泌される。
図2 糖転移酵素の分泌。多くの糖転移酵素は通常、細胞内のゴルジ体と呼ばれる小器官の膜に突き刺さって存在し、糖鎖を生合成する。一部の糖転移酵素は、プロテアーゼによって切断され、活性を保ったまま細胞外へ分泌される。
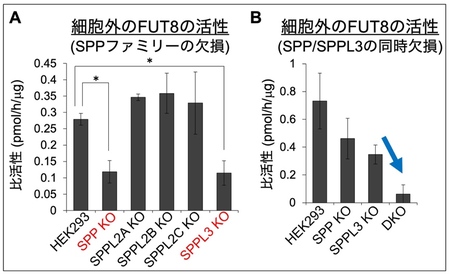
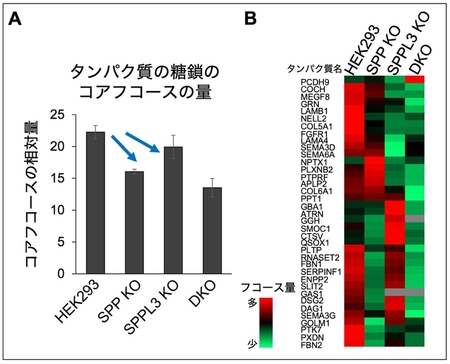
本研究ではまず、FUT8の分泌に関わるプロテアーゼの同定を試みました 。最近、SPPL3 9)と呼ばれるプロテアーゼが、複数の糖転移酵素を切断し、分泌させることが明らかになっています。そこで、SPPL3や、SPPL3と機能が類似するプロテアーゼの関与を検証するため、SPPL3、および同じファミリー10)に属する、SPP、SPPL2A、SPPL2B、SPPL2Cをそれぞれ欠損させたノックアウト11)細胞 (KO細胞)を作製し、FUT8の分泌量を調べました。その結果、SPPのKO細胞とSPPL3のKO細胞においては、細胞外に分泌されるFUT8の量が通常の細胞 (図3A中のHEK293 細胞12)) に比べて約半分程度に減少していました(図3A)。さらに、SPPとSPPL3を両方欠損させた細胞 (DKO細胞) では、FUT8が細胞外にほとんど分泌されなくなりました(図3B)。一方、SPPL2A、SPPL2B、SPPL2CのKO細胞では細胞外のFUT8の減少は見られませんでした。これらのことから、FUT8はSPPとSPPL3にそれぞれ切断されて、細胞外へ分泌されることがわかりました。
A : ヒトの培養細胞(HEK293細胞)と、SPP、SPPL2A、SPPL2B、SPPL2C、SPPL3をそれぞれ欠損させたHEK293細胞を用い、細胞外へ分泌されたFUT8の活性を測定した。SPP欠損細胞およびSPPL3欠損細胞では、細胞外に存在するFUT8の量がHEK293細胞に比べ減少した。
B : HEK293細胞、SPP欠損細胞、SPPL3欠損細胞、SPP/SPPL3 double欠損(DKO)細胞について、Aと同様の実験を行った。
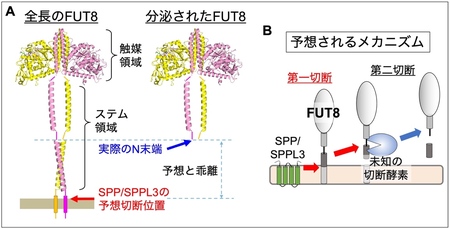
次に、FUT8が切断されて分泌されるメカニズムをさらに詳しく調べるため、細胞外に分泌されたFUT8を精製し、N末端13)のアミノ酸配列14)を調べました。その結果、細胞外のFUT8のN末端は、ステム領域15)のほぼ中央付近であることがわかりました(図4A)。これまでの研究で、SPPやSPPL3は、膜を貫通している領域近傍でタンパク質を切断することがわかっていましたが、同定されたステム領域内のN 末端は、SPPやSPPL3による予想切断位置と大きく乖離していました。このことから、FUT8はSPPもしくはSPPL3により切断された後、また別のプロテアーゼによってさらに切断されるという、2 段階の切断を受けている可能性が考えられました(図4B)。
A : 全長のFUT8の構造(左)と、細胞外に分泌されたFUT8の構造(右)。SPP、SPPL3は、膜貫通領域の末端付近を切断することが知られている。一方、分泌されたFUT8のN末端は、ステム領域の中央付近であることがわかった。
B : 予想されるFUT8の切断メカニズム。まずSPPもしくはSPPL3によって膜近傍の領域が切断され、その後に未知の酵素により二段階目の切断が起こると考えられる。
最後に、FUT8が切断、分泌されることの意義について調べました。これまで、糖転移酵素が切断分泌されることによって、糖転移酵素の活性や基質特異性16)が変化することが報告されています。そこで、グライコプロテオミクス17)という方法を用い、FUT8によってどのようなタンパク質にコアフコースが付けられたのかを網羅的に調べました。その結果、SPPやSPPL3を欠損した細胞では、タンパク質に付いたコアフコースの量が減少していました(図5A)。さらに、詳細に調べたところ、SPPとSPPL3の欠損細胞では、コアフコースが減少したタンパク質の種類が異なることがわかりました(図5B)。このことから、SPPやSPPL3によってFUT8が切断、分泌されると、FUT8の糖鎖合成機能が変化し、一部のタンパク質へのコアフコースの付加の度合いが変化することがわかりました。つまり、SPPやSPPL3による切断は、FUT8がどのようなタンパク質にコアフコースを付けるのかという、基質特異性を変化させることがわかりました。
A : SPP、SPPL3、もしくは双方が欠損したHEK293細胞の培養培地中のタンパク質について、グライコプロテオミクスと呼ばれる手法を用い、コアフコースがついたタンパク質を網羅的に調べた結果。
B : Aの分析において、コアフコースがついたタンパク質の中で、コアフコースの量が多いものを赤、少ないものを緑で表示した。
今後の展開
本研究は、コアフコース合成酵素であるFUT8の分泌の仕組みとその意義を明らかにしました。FUT8が作るコアフコースの量の増減は、炎症、COPDや感染症の重症化、がんや精神疾患など、様々な疾患との関わりが報告されています。これまで、FUT8の活性を細胞内で制御する仕組みについてはほとんどわかっておらず、本研究によりその仕組みの一端が明らかになりました。本研究の成果は今後、ヒトの細胞が持つ複雑な糖鎖の生合成の仕組みの解明と、コアフコースが関わる様々な疾患の病態解明や治療への応用が期待されます。
用語解説
1)糖鎖:グルコース (ブドウ糖) などの糖が鎖状につながった物質。遊離の状態で存在するものもあれば、タンパク質や脂質に結合した状態のものもある。デンプン、グリコーゲンなどの多糖では、数多くの糖がつながり、糖鎖だけで遊離の状態で存在する。一方タンパク質に結合したものは、数個から20個程度の糖がつながったものが多い。
2)糖転移酵素:糖鎖を合成する酵素のことで、ヒトでは180種類程度存在することが知られている。主に、細胞の中のゴルジ体と呼ばれる小器官に存在している。
3)FUT8:糖鎖を合成する糖転移酵素の一種で、細胞の中のゴルジ体に存在し、コアフコースと呼ばれる糖鎖の部分構造を作る。
4)N型糖鎖:タンパク質に付く糖鎖の種類の1つで、タンパク質のアスパラギン残基(アミノ酸の1文字表記法でNと表記)に結合している。ヒトでは7,000種類以上のタンパク質がN型糖鎖を持つと考えられている。
5)慢性閉塞性肺疾患(COPD):肺気腫や慢性気管支炎の総称。気道の閉塞による呼吸困難を引き起こす。世界保健機関(WHO) によれば、2021年の世界の死亡原因の4位を占めている。COPD は Chronic Obstructive Pulmonary Disease の略。
6)COVID19:2019年に発生し、世界的流行をもたらした新型コロナウイルス感染症。
7)ゴルジ体:細胞の中の膜に隔てられた小器官の一つで、糖鎖の合成やタンパク質などの生体分子の輸送などを行なっている。
8)プロテアーゼ:タンパク質を切断する酵素の総称。
9)SPPL3:プロテアーゼの一種で、Signal peptide peptidase like 3の略。小胞体やゴルジ体などの細胞内小器官に存在し、糖転移酵素などを切断することで細胞外へ分泌させることが知られている。
10)ファミリー:遺伝子の複製により生じた複数の類似遺伝子のこと。それらの遺伝子ファミリーから作られるタンパク質も、類似のアミノ配列を持つことから、類似した機能を持つ。
11)ノックアウト:特定の遺伝子を改変してその機能を失わせること。現在では、世界中の研究室で、ゲノム編集技術などにより培養細胞や実験モデル動植物などの遺伝子のノックアウトが行われている。しばしばKO (knockout)と略される。
12)HEK293細胞:ヒト胎児腎臓由来の培養細胞。生命科学の実験に汎用される。
13)N末端:タンパク質の末端の一つで、遊離のアミノ基(NH2)が存在する側の末端。もう一端はC末端で、遊離のカルボキシ基が端にある。タンパク質は、N末端からC末端に向かって、アミノ酸がペプチド結合で連なることによって作られる。
14)アミノ酸配列:タンパク質やペプチドを構成する鎖状につながったアミノ酸の順番のこと。
15)ステム領域:糖転移酵素において、膜を貫通する領域と、糖を転移する触媒領域をつなぐ領域のこと。
16)基質特異性:酵素が行う反応において、特定の構造を持った物質のみを厳密に酵素が認識して反応する性質のこと。基質とは、化学反応における出発物質のこと。酵素と基質は鍵と鍵穴の関係に例えられる。
17)グライコプロテオミクス:プロテオミクス(試料中に含まれているすべてのタンパク質の種類を特定する解析手法)を応用し、試料中の糖タンパク質を網羅的に解析する手法。糖タンパク質の上のどこにどのような構造の糖鎖が付いているかを特定できる。
論文情報
雑誌名:The Journal of Biological Chemistry
論文タイトル:Signal peptide peptidase (SPP)- and SPP-like 3 (SPPL3)-dependent shedding of α1,6-fucosyltransferase (FUT8) differentially affects core fucosylation
著者:Seita Tomida, Rebeca Kawahara, Kristina M. Bienes, Yuko Tokoro, Takahiro Yamasaki, Yasuhiko Kizuka* (*責任著者)
DOI: 10.1016/j.jbc.2026.111209